Présentation et description
 Lérot, Frontenas, juin 2014 © J.P.Rulleau
Lérot, Frontenas, juin 2014 © J.P.Rulleau
Parmi les trois espèces de gliridés présentes en France, deux ont une taille et une morphologie similaires avec un comportement proche, le loir gris Glis glis et le lérot Eliomys quercinus. Malgré cela, ils ne peuvent être confondus. Le lérot, appelé également loir lérot, loir des greniers, rat des greniers, rat bayard ou liron est une espèce polytipique[1]. Neuf sous espèces et deux morphotypes : quercinus et lusitanicus, sont décrits (BERTOLINO et al., 2008 ; FILIPPUCI 1999 ; PEREZ et al., 2013). Le lérot présente un dessus gris – brun roussâtre, le ventre et les pattes sont blancs. Un masque caractéristique autour des yeux se prolonge sous les oreilles qui sont grandes. Sa queue longue et velue se termine par une touffe noire et blanche. La peau de la queue est fragile et se détache aisément, comme chez les autres gliridés. Il s’agit d’un mécanisme de défense pour échapper aux prédateurs. (Mc DONALD & BARRETT, 1995). L’adulte pèse entre 45 et 120 g, jusqu’à 210 g. avant l’hibernation. Ses dimensions sont les suivantes : longueur tête et corps : 108 – 156 mm ; longueur de la queue : 97 – 147 mm ; longueur du pied postérieur : 23 – 32 mm ; hauteur du pavillon de l’oreille : 15 – 24 mm (QUERE & LE LOUARN, 2011). Les femelles possèdent 8 tétines (Mc DONALD & BARRETT, op.cit.).
Le domaine vital est vaste et peut atteindre plusieurs milliers de m2. Il semble, du moins en altitude, que ceux des mâles soient plus grands que ceux des femelles (BERTOLINO et al., 2003). Le lérot semble bien connaître les éléments constitutifs de ce domaine vital. L’espèce étant territoriale, la tolérance intraspécifique existe mais elle est faible et les affrontements sont fréquents (QUERE & LE LOUARN, op.cit.). Cependant, le groupe familial se maintient, durant quelques semaines après la mise bas. Le territoire est permanent d’une année sur l’autre. Les densités ne dépassent pas 10 individus par ha en milieu forestier, mais peuvent être plus élevées de l’ordre de 30 à 50 individus par ha dans les milieux favorables et proches des habitations. (QUERE & LE LOUARN, op.cit.). Le lérot est le moins arboricole des gliridés européens (Mc DONALD & BARRETT, op.cit.) et il a besoin de milieux dans lesquels les affleurements rocheux, les murets, présentent une superficie importante d’au moins un tiers du domaine vital utilisé. (BERTOLINO et al., op. cit. et QUERE & LE LOUARN, op.cit.). Comme le mentionne ces auteurs, le lérot est une espèce saxicole[2], ce qui explique, en partie, sa présence en haute altitude. Il vit aussi bien en plaine en forêts caducifoliées[3], qu’en montagne, dans les forêts de haute altitude, composées en majorité de conifères. Il apprécie les vergers, les jardins et les arbres fruitiers. Il fréquente les maisons et les greniers sont des sites d’hibernation. C’est le gliridé qui passe le plus de temps au sol.
La période de reproduction commence dès la sortie d’hibernation. Les mâles se réveillent plusieurs fois pendant celle–ci. Peu avant sa fin, la spermatogénèse a démarré. La période d’activité des femelles est plus courte, conduisant à la production d’une seule portée, excepté dans le sud de l’Europe où il y en a éventuellement deux (QUERE & LE LOUARN, op.cit.). Il construit un nid sphérique avec une entrée latérale, garni à l’intérieur de plumes et de poils, et constitué à l’extérieur de mousses et d’herbes. Il peut utiliser des constructions d’autres animaux, en les modifiant, comme les nids d’écureuils, voire de passereaux. Ce nid est placé dans un arbre creux, un muret, un mur, un buisson, entre les fenêtres et les volets d’une maison (IBORRA obs. pers.). La construction démarre à partir du mois d’avril. Les portées sont de l’ordre de 1 à 9 jeunes, le plus souvent 4. La durée de gestation est de 22 à 24 jours. L’allaitement dure de 4 semaines à un mois. Au sevrage, leur poids est d’environ 20 g et leur longueur proche de 9 cm (FILIPPUCI, op.cit. ; QUERE & LE LOUARN, op.cit.). L’activité est très majoritairement nocturne, cependant, il peut être observé en journée. Cette activité diurne est sans doute liée à la reproduction.
A partir de fin août en altitude et de septembre en plaine, l’activité commence à décroitre, puis ralentit. En même temps, le poids augmente beaucoup, c’est le début de la phase d’hibernation dont le stimulus primaire semble être le stockage des graisses (FILIPPUCI, op.cit.). En altitude, il peut y avoir un arrêt de la croissance des jeunes pendant l’hibernation. La croissance reprend à la sortie de celle-ci. Les mâles adultes s’endorment les premiers, puis les femelles et enfin les jeunes. L’hibernation a lieu d’octobre à avril. La température corporelle descend jusqu’à + 5°C et les battements du cœur passent de 300 contractions par minute à 2,5 contractions par minute pendant cette période (Mc DONALD & BARRETT, op.cit.). Peu d’adultes conduisent deux saisons de reproduction car le taux de mortalité en hibernation est important. Le régime alimentaire est varié avec une prédominance carnée, constituée d’insectes (imagos et larves, surtout des lépidoptères) et de gastéropodes (FILIPPUCI, op.cit. ; QUERE & LE LOUARN, op.cit.). La consommation d’œufs de passereaux est courante et la prédation d’adulte en train de couver également. La nourriture végétale est également variée, allant des bourgeons aux baies et aux akènes[4].
Le lérot est quasi menacé au niveau mondial BERTOLINO et al., 2008). Il est presque menacé en Europe. En France, sa préoccupation est mineure (UICN, 2017), cependant l’évolution de ses populations est inconnue. Il en est de même en Rhône-Alpes (De THIERSANT & DELIRY, 2008). Il ne bénéficie pas de statut de protection en France, il est sans statut dans la directive habitat et est inscrit en annexe 3 de la convention de Berne.
[1]Polytipique: : taxon qui comprend plusieurs sous – espèces par opposition à un taxon qui ne comprend qu’une espèce nominale.
[2] Saxicole : espèce adaptée à l’utilisation des affleurements rocheux et des éboulis.
[3] Caducifoliée : se dit d’une forêt constituée d’essences qui perdent leur feuillage en hiver, arbres à feuilles caduques, qui tombent à la mauvaise saison.
[4] Akène : fruit sec
Etat des connaissances
Historique
Le lérot est un rongeur d’origine européenne (BERTOLINO, 2017). Historiquement, il est présent en continu de l’ouest de l’Oural jusqu’aux côtes ouest de l’Europe. Cependant, son aire de répartition se contracte fortement d’est en ouest. Cet auteur considère que l’espèce n’occupe plus, en 2015, que 47 % de son aire de répartition de 1978 et 67 % de de son aire de répartition de 2008, soit des contractions respectives de l’ordre 63 % en 37 ans et 43 % en 10 ans qui montrent que le phénomène s’accélère.
 Etat des connaissances du lérot
Etat des connaissances du lérot
Distribution actuelle
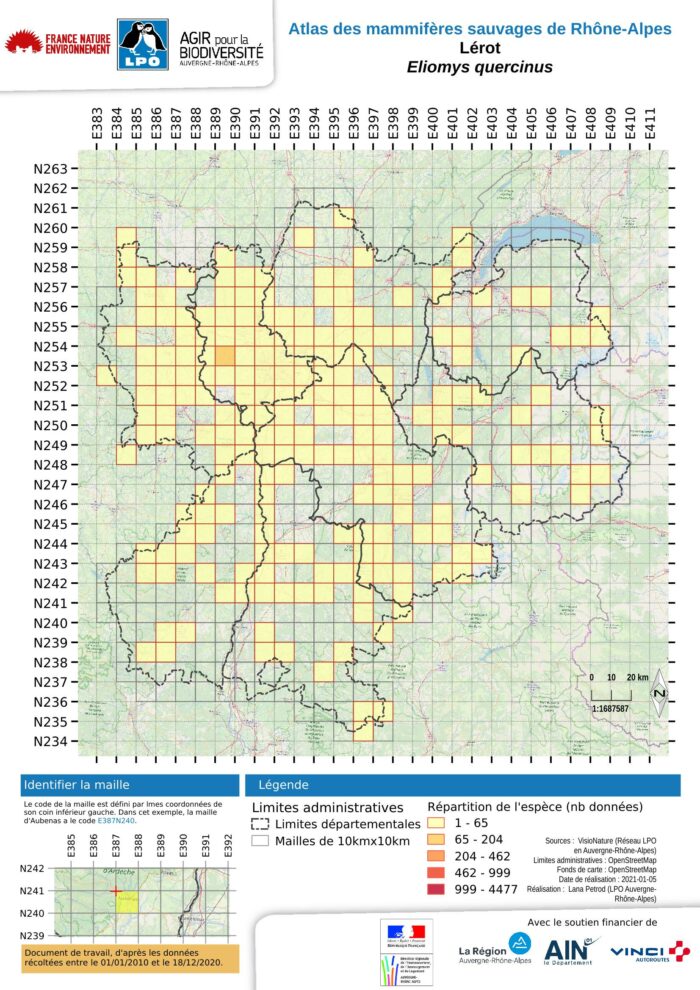
En France, le lérot est présent partout sauf en Bretagne où sa répartition est morcelée. Il a été introduit en Corse aux alentours de 1000 ans avant J.C. (PASCAL et al., 2006). Le lérot est connu en Rhône-Alpes depuis au moins 1904 avec une première mention dans l’Ain à Gex. En Dombes, Bussy relate pour les hivers 1966-67 et 1967-68, des captures de plus 900 animaux par hiver. Les nids d’hibernation qui peuvent permettre à plusieurs animaux de se regrouper, se trouvent dans les trous des murs en pisé. Cet auteur mentionne que toutes les fermes en pisé possèdent, à l’époque, leur colonie de lérots. Si les agriculteurs abandonnent leur ferme, les lérots en disparaissent ce qui a pu pousser à croire en l’anthropophilie de l’espèce (BUSSY, 1972). Le lérot est aujourd’hui présent dans tous les départements de Rhône-Alpes. Avant 2004, en estimant la superficie rhônalpine occupée à partir des mailles de l’atlas, le lérot occupait environ 20% de la surface, soit 8400 km2 (N = 84 mailles occupées de 1904 à 2004). De 2005 à 2018, sa présence a été découverte dans 135 mailles supplémentaires, soit une augmentation de 31 % de son aire de présence en Rhône-Alpes (13500 km2). Aujourd’hui, le lérot occupe la moitié de la superficie de Rhône-Alpes (N = 219 mailles), soit environ 21900 km2. Ces chiffres sont uniquement le reflet d’une meilleure prospection et masquent des disparités locales importantes. L’effort de prospection a certes abouti à un nombre de données 3,5 fois supérieur entre 2005 et 2018 (N = 611 données) à ce qui existait entre 1904 et 2004 (N = 176 données), mais nous estimons qu’il faut rester très vigilant quant à l’état de conservation des populations. Ceci est d’autant plus vrai, que le nombre de données par mailles est toujours très faible, compris entre 1 et 34. Les plages de répartition effective et continue, sont situées d’Annecy au nord-est à Valence au sud-ouest. L’analyse plus fine de la répartition par maille met en évidence trois éléments majeurs :
- une répartition morcelée dans les deux départements à influence méditerranéenne (Ardèche et Drôme), morcellement déjà identifié par PENEL et al. (1984), pour l’Ardèche;
- elle est également fragmentée dans trois des quatre départements montagnards : l’Ain et les deux savoies. En Haute-Savoie, la mise en évidence de l’espèce date seulement d’après 2005 (N = 11), la première donnée de C. Prévost datant de 2007 à Moye, à 1007 m dans un nichoir ;
- une plage de répartition continue d’ouest en est incluant la Loire (AULAGNIER et al, 1983), le Rhône, département où le lérot est le plus présent (ARIAGNO et al., 1981), le sud de l’Ain et l’Isère. Dans ce dernier département, la répartition redevient plus morcelée au fur et à mesure que l’on avance vers le sud-est.
L’analyse de la répartition des observations entre 1904-2004 et 2005-2018, période stricte de prise en compte des données pour le présent atlas, met en évidence que le lérot n’a été que retrouvé que dans les deux tiers des mailles où sa présence était avérée avant 2005. Sur ces mailles-là, il y a donc une contraction proche de 30 % à l’échelle régionale, qui pourrait être expliquée par une absence de prospection. Malgré un statut de conservation en Rhône-Alpes considéré en préoccupation mineure, les populations pourraient montrer des baisses sensibles, équivalentes à ce qui est observé dans d’autres pays d’Europe (BERTOLINO, op.cit.).
L’amplitude altitudinale est large. En effet, en Rhône-Alpes, il est présent de 94 m à Livron-sur-Drôme (G. Bernard, 2014) et à Loriol-sur-Drôme (LPO Drôme, 1997 et 2014), jusqu’à 2456 mètres à Mercury en Savoie (F. Gueguen, 2008) soit 2362 mètres d’écart. En Isère, l’altitude maximale est de 2062 m à Saint-Christophe-en-Oisans (Q. Revel, 2014). Ces altitudes maximales sont équivalentes à ce qui est observé en région PACA, où au moins 5 données sont faites à des altitudes au moins égales à 2250 m.
Menaces et conservation
Comme beaucoup d’autres espèces de petits mammifères, les lérots subissent la prédation des rapaces et carnivores généralistes, ce qui est un prélèvement naturel. Cette espèce apprécie avant tout les milieux boisés et a besoin d’éléments rocheux. Elle est absente des prairies et des milieux ouverts en général. La principale menace est la modification de ses habitats (BERTOLINO, op. cit .). Quand il est à proximité des maisons, voire à l’intérieur de celles-ci, il peut engendrer des dégâts. De ce fait, il subit des actions de dératisation. Les gliridés présentent toujours des populations à faible densité comme le mentionnent BRIGHT et MAURIS (1996), en s’appuyant sur une étude du Muscardin Muscardinus avellanarius. C’est également le cas du lérot en milieu naturel en Rhône-Alpes selon les données récoltées depuis 2005. Les populations en densité peu élevée sont fragiles. On peut penser que la principale menace, réside dans le manque de connexions entre celles-ci, comme pour beaucoup d’espèces. C’est pourquoi, en termes de gestion, nous pensons qu’il est indispensable de bien s’appuyer sur les outils territoriaux comme les trames vertes pour favoriser le maintien et les connexions des populations de ce rongeur.
Vers un nouveau statut de conservation dans une nouvelle liste rouge ?
La production d’une liste rouge Auvergne-Rhône-Alpes à partir des données des deux atlas permettrait de mettre en avant des évolutions de certaines espèces comme le lérot. En effet, le lérot est maintenant considéré comme quasiment menacé à l’échelle européenne, (BERTOLINO, op. cit.), statut qui pourrait lui être appliqué en Rhône-Alpes. Nous souhaiterions attirer l’attention dans le cadre de ce focus sur l’intérêt de réviser et d’adapter, à l’échelle de la grande région, pour certaines espèces, la liste rouge des mammifères qui, pour l’ancienne région Rhône-Alpes, a plus d’une décennie (celle d’Auvergne date de 2015). Le travail remarquable (De THIERSANT & DELIRY, op. cit.), réalisé selon la méthodologie rigoureuse de l’UICN, mérite une révision des statuts de conservation intégrant l’évolution des connaissances des deux anciennes régions. Le lérot en est, à notre sens, un excellent exemple. Au même titre que le travail qui a été fait en ce sens à l’échelle européenne par BERTOLINO (op. cit.), l’ensemble des éléments de cette monographie, nous font pressentir que cela pourrait nous conduire à ne plus le classer en préoccupation mineure mais comme vulnérable à l’échelle régionale.
Rédacteurs : Olivier IBORRA et Benoit FEUVRIER, janvier 2020






