Présentation et description
 Ecureuil roux_©Marc Crouzier
Ecureuil roux_©Marc Crouzier
Sciurus en latin a été emprunté au grec grec skiouros, composé de skia, qui signifie « ombre » et de ouros, la queue (Biancardi & Do Lin San, 2006). Au sens littéral, l’écureuil est donc un animal « qui fait de l’ombre avec sa queue » ou encore «qui s’abrite à l’ombre de sa queue ». Dans les temps anciens, le sobriquet de « fouquet » lui était attribué. C’est probablement pour cette raison que les ancêtres de Nicolas Fouquet (1615-1680), sur-intendant des finances de Louis XIV, ont fait figurer deux écureuils dans leurs armoiries familiales. Le surnom de « Roussel » qui lui est attribué dans le Roman de Renart a trait à son pelage (Biancardi & Do Lin San, op.cit). Malgré son capital de sympathie, l’écureuil ne semble pas avoir d’autre nom populaire valable pour l’ensemble du territoire national, mais des noms locaux liés aux patois ou dialectes. C’est d’ailleurs le cas en Rhône-Alpes, en patois savoyard, où l’agile rongeur est appelé (la) vardiaf.
L’écureuil roux est le plus grand des rongeurs forestiers. Diurne, il est arboricole et il fréquente tous les habitats où de grands arbres sont présents, forêts de tous types, bien entendu, mais également parcs urbains. Bien que sa morphologie soit adaptée à ce mode de vie, notamment grâce à sa queue multifonctionnelle, il est fréquent de le voir au sol à la recherche de nourriture.
Facilement reconnaissable avec ses grands yeux noirs et sa longue queue en panache, son pelage est généralement uniforme sur le dos et la tête, de couleur très variable selon les régions : roux, gris-brun, brun-roux, roux-noir, brun foncé plus ou moins chamoisé, noir (Chapuis & Marmet, 2006). Selon ces auteurs, il existe un cline de pelage du sud-ouest au nord-est ; la proportion de morphes sombres décroît du sud-ouest au nord-est, excepté en zones montagneuses où le morphe noir peut dominer. Biancardi & Do Lin San (op.cit. ) attirent l’attention sur le polymorphisme du pelage de l’écureuil. Ils mentionnent trois formes principales de pelage : une rouge, une brune et une mélanique. Le ventre est blanc. Les oreilles se terminent par un pinceau de poils de 2,5 à 3 cm de long qui croît en fin d’été et est proéminant en hiver et au printemps. La queue est longue, bien fournie, en panache, de couleur uniforme, parfois partiellement blanche (en Grande-Bretagne et rarement en France). Il n’y a pas de dimorphisme sexuel. De même, les jeunes sont identiques aux adultes, gabarit excepté (Chapuis & Marmet, op.cit.). Si les différences observées d’un individu à l’autre sont génétiques, la fourrure de chaque animal présente des variations de couleurs et de densité. Deux mues annuelles existent. La première au printemps et la seconde en automne. Une seule concerne la queue et les pinceaux qui ornent les oreilles, elle débute en été. En hiver sa fourrure s’épaissit, ce qui lui permet de ne pas hiberner, contrairement à d’autres petits mammifères, comme les gliridés par exemple. Le pelage d’été est plus fin, donc là encore adapté à la température, cette fois ci la chaleur. Les pinceaux disparaissent des oreilles, et la queue, moins touffue, présente une coloration généralement similaire à celle du dos. Les données morphologiques adultes les plus répandues sont les suivantes : longueur tête corps : 206-250 mm – longueur de queue : 150-205 mm – longueur du pied postérieur : 51-63 mm – longueur de l’oreille : 25-36 mm – formule dentaire : i 1/1, c 0/0, p 2/1, m 3/3, total 22 (Lurz et al., 2005).
L’écureuil appartient à l’ordre des rongeurs, au sous-ordre des sciuromorphes et à la famille des sciuridés, représentée en France par deux espèces indigènes (l’écureuil roux et la marmotte). Les trois autres espèces localement présentes en France sont toutes d’origine lointaine : l’écureuil gris (Sciurus carolinensis), l’écureuil de Pallas (Callosciurus erythraeus) et le tamia de Sibérie ou écureuil de Corée (Tamias sibiricus).
En Rhône-Alpes, seule cette dernière espèce est présente (cf. monographie Tamia de Sibérie).
Les études génétiques ont permis de réduire considérablement le nombre de sous-espèces décrites auparavant sur des critères morphologiques ou phénotypiques (pelage). Actuellement, en Europe, et plus particulièrement en France, une seule sous-espèce est présente : S. v. fuscoater (Dozières et al., 2012). Une autre sous-espèce, S. v. meridionalis, localisée dans le sud de l’Italie, a été récemment élevée au rang d’espèce, S. meridionalis (Wauters et al., 2017).
Dans le récent atlas des mammifères terrestres du bassin genevois (Gilliéron & Morel, 2018), la sous-espèce S.v. cinerea est mentionnée. Cette dernière est un synonyme de S.v. fuscoaster.
A l’échelle mondiale (Eurasie), l’état de conservation de l’espèce semble satisfaisant (IUCN, 2019). La préoccupation est également mineure pour les populations françaises et régionales (UICN France, 2017 ; De Thiersant & Deliry, 2008). Autrefois détruit en raison des dégâts occasionnés aux peuplements forestiers et chassé pour sa chair, il est aujourd’hui protégé au plan national depuis l’arrêté du 18 avril 1981. L’écureuil roux ne bénéficie pas de statut au titre de la directive habitat faune flore. Il est inscrit à l’annexe III de la convention de Berne.
C’est un animal solitaire, excepté durant la période de reproduction (Chapuis & Marmet, op.cit.). Diurne, il est actif tout au long de l’année. Il y a généralement, un pic d’activité en fin de matinée durant l’hiver. En été deux pics d’activité sont observés, 2 à 4 heures après le lever du soleil et avant le coucher du soleil. Il adopte un rythme d’activité intermédiaire en automne et au printemps. Il n’y a pas d’hibernation pendant la mauvaise saison. Il peut rester plusieurs jours dans son nid lorsque les conditions climatiques hivernales sont mauvaises (vents forts, fortes pluies). Les températures hautes ou basses s’accompagnent d’une réduction de l’activité, dépendante également des disponibilités alimentaires.
L’organisation sociale est déterminée sur une hiérarchie de dominance pour chaque sexe et entre sexes. Les dominants sont généralement plus vieux et plus gros que les dominés et ont un domaine vital de plus grande superficie (Chapuis & Marmet, op.cit. ; Biancardi & Do Lin San, op.cit. ; Mc Donald & Barrett, 1995). La superficie du domaine vital varie en fonction du type d’habitat et des disponibilités en nourriture. Celui des mâles est 2 à 3 fois supérieur à celui des femelles : entre 2 et 20 ha pour les femelles et entre 5 et 31 ha pour les mâles. Les domaines vitaux des individus des deux sexes se chevauchent, particulièrement dans les secteurs où les ressources trophiques sont abondantes. Les individus identifient leur domaine vital par des marquages olfactifs (urine, secrétions glandulaires, vaginales pour les femelles), renseignant notamment les mâles sur le stade de reproduction des femelles (Chapuis & Marmet, op.cit. ; Biancardi & Do Lin San, op.cit.). Les émissions sonores sont assez variées : cri d’alarme, parfois un caquetage, des grognements ou des lamentations. Lors de poursuites, ils poussent des ronflements aigus ou des sons flûtés. Il est très à l’aise et passe le plus clair de son temps dans la canopée. Il est également observé au sol pour la recherche de nourriture. Très agile au cours de ses déplacements dans les arbres, il trouve principalement refuge dans des nids construits avec des branches feuillées coupées sur l’arbre, et plus rarement dans une cavité d’arbre. Les nids, adossés au tronc ou à la fourche d’une branche, présentent une cavité de 12-16 cm de diamètre. L’intérieur est garni de mousse, feuilles, herbes sèches qu’il transporte dans sa gueule. Sa hauteur est variable selon les peuplements forestiers. Un individu utilise plusieurs nids (2, 3, voire plus).
La reproduction est marquée par deux pics. Le premier en hiver (décembre à janvier) et le second au printemps. Il y a polygynie (un mâle peut s’accoupler avec plusieurs femelles) de promiscuité, le mâle dominant assurant l’accouplement. Il y a également une polyandrie (une femelle peut s’accoupler avec plusieurs mâles). Les mâles sont féconds durant toute la saison de reproduction. Les femelles présentent plusieurs cycles œstraux mais elles ne sont fécondables seulement un jour durant chaque cycle. Une masse corporelle doit être atteinte pour l’entrée en œstrus (300 à 325 g selon les études). La durée de gestation est comprise entre 38 à 40 jours. Le nombre de jeunes/portée par an varie de 1 à 6 (3 à 4 généralement). Les femelles ont huit mamelles. Le nombre de portées/an (1 ou 2) est influencée par la condition physique des individus, fonction des disponibilités alimentaires. Deux pics de naissance sont observés, l’un au printemps (entre février et avril) et l’autre en été (entre mai et août). Les jeunes naissent nus, aveugles et sourds. Ils pèsent entre 10-15 g. Ils commencent à quitter le nid à 40 – 45 j et sont sevrés à 8-10 ou 10-12 semaines selon les auteurs. Les mâles n’interviennent pas dans l’élevage des jeunes. Face à une menace, la femelle transporte ses petits dans un autre nid. Le sexe-ratio est proche de 1/1, variable selon les sites. La maturité sexuelle varie entre 10 et 12 mois, mais beaucoup de femelles ont leur 1ère portée durant leur 2ème année. En nature, l’espérance de vie à six mois est de 3 ans environ. Certains individus peuvent vivre jusqu’à 7 ans, voire au-delà de 10 ans en captivité (Chapuis & Marmet, op.cit. ; Biancardi & Do Lin San, op.cit.). Les jeunes restent quelques mois à proximité de leur nid de naissance, puis se dispersent. La dispersion d’été correspond aux déplacements des jeunes nés au printemps, alors qu’à l’automne, elle concerne à la fois les adultes et les jeunes. Selon les saisons, elle serait le fait principalement des mâles au printemps et des femelles à l’automne. La dispersion des femelles serait en rapport avec la distribution des ressources alors que celle des mâles serait fonction de la répartition des femelles (Chapuis & Marmet, op.cit. ; Biancardi & Do Lin San, op.cit.).
C’est un animal forestier, omnivore par opportunisme. Il apprécie tous les types de forêts : conifères (mélèze, pin, sapin), forêts mixtes (feuillus-conifères) et forêts de feuillus. Les habitats mixtes matures sont plus favorables à l’espèce, en liaison avec leurs disponibilités trophiques. Ils exploitent préférentiellement, lorsque cela est possible, les taillis sous-futaies et les futaies jardinées. Il fréquente également les petits bois, les bocages. Son aire de répartition, coïncide donc logiquement avec la limite arborée, approximativement 2000 mètres dans les Alpes. Les forêts sont très attractives pour ce rongeur. Elles lui apportent, couvert, tranquillité et quantité de nourriture. Elles lui offrent l’environnement tridimensionnel que les écureuils peuvent exploiter à merveille de par leurs caractéristiques anatomiques : non seulement le sol et les frondaisons des arbres mais également la verticalité des troncs. Dans ce cadre il apprécie les réseaux de branches très denses, car ceux-ci lui permettent de se déplacer, à grande vitesse, de l’un à l’autre, sans avoir à effectuer d’incursions au sol où ils sont plus exposé aux prédateurs (autour des palombes, renard, etc.). Les parcs et jardins urbains sont bien utilisés y compris en plein cœur de villes (Résouki et al., 2014).
Etat des connaissances
Historique
L’ancêtre commun des écureuils aurait vécu durant l’Éocène (-56 à -34 millions d’années), époque marquée par l’apparition des premiers mammifères. Protosciurus sp., le plus ancien mammifère connu de la famille des Sciuridés, est apparu au début de l’Oligocène (-34 à -29 MA), et le genre Sciurus, il y a environ 20 MA. L’espèce est présente en Europe depuis le Pléistocène (avant la glaciation würmienne, Chapuis et al., 2012).
Espèce répartie de l’Europe à la Sibérie, la réduction de son aire de répartition européenne ne semble due qu’à la concurrence avec l’écureuil gris en Angleterre. L’écureuil roux est assez courant en France mais absent de Corse, et également des îles atlantiques, sauf l’île d’Oléron et l’île aux Moines (Chapuis et al., 2012). Il serait en léger déclin dans la moitié ouest du pays (Maurin et Haffner, 1995). Dans le précédent atlas des mammifères de Rhône-Alpes, il est mentionné que l’écureuil roux « est présent dans tous les secteurs boisés de la région, à l’exception des garrigues où il serait rencontré en faibles densités ».
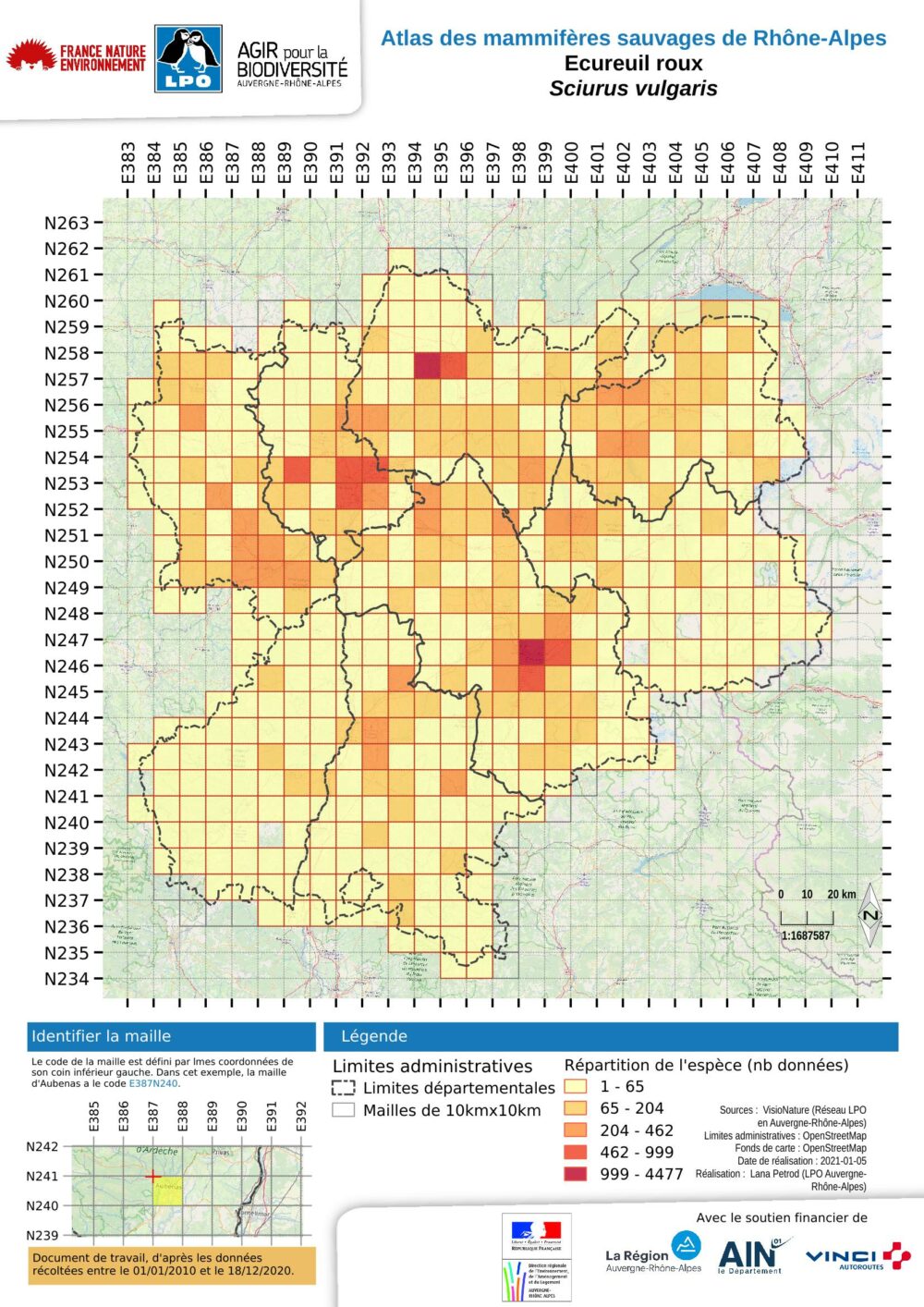 Etat des connaissances de l'écureuil roux
Etat des connaissances de l'écureuil roux
Distribution actuelle
L’écureuil roux est présent dans l’ensemble de la région Rhône-Alpes. C’est le troisième mammifère le plus noté dans les bases de données. Il occupe 388 des 405 mailles du présent atlas, soit 96 % de celles-ci (N= 405). Ceci représente 88 % de la superficie régionale, soit 38800 km². Il y a toutefois des fluctuations de populations dans le département l’Ain. Les principales absences sont situées sur les bordures orientales de la Savoie, de la Haute-Savoie et du sud-est de l’Isère, ce qui peut être expliqué aisément par les hautes altitudes de ces secteurs. Des absences en Isère et dans le sud-ouest de la Loire sont moins facilement explicables et probablement dues à des manques de prospection.
Trois éléments expliquent la répartition actuelle :
comme en Auvergne, la densité des données correspond davantage à la pression d’observation qu’à la densité réelle des animaux (GMA, 2015) ;
Rhône-Alpes est une région où la forêt est très présente avec un taux de boisement supérieur au taux national mais celui-ci reste très variable d’un département à l’autre (de 23% pour le Rhône à 52% pour l’Ardèche) ; elle présente une diversité de forêts assez remarquable qui sont favorables à l’espèce ;
Rhône-Alpes est une région fortement urbanisée. Plus de la moitié de son territoire est constituée d’espaces à dominante urbaine (pôles urbains et couronnes péri-urbaines, Cochet & Fonters, 2015). Ce maillage dense contraint fortement les milieux naturels, mais les arbres y subsistent. Les espaces verts, les quartiers résidentiels, et les jardins deviennent alors pour l’écureuil roux des milieux de substitution.
Globalement la carte présente des noyaux de plus forte présence qui correspondent tous à des centres urbains. Dans l’ouest de la région, une diagonale allant de l’agglomération stéphanoise dans la Loire à Bourg-en-Bresse (01) au nord/nord-est est perceptible. Mais c’est aussi le cas pour toutes les autres agglomérations de taille intermédiaire. Cela s’explique globalement par le capital sympathie de l’espèce chez les observateurs urbains. Cela représente effectivement une présence dans les parcs urbains mais cela ne peut être interprété comme une densité plus forte que dans les zones rurales. Cette polarisation des zones de fortes concentrations de l’espèce autour et dans les centres urbains est marquée aussi sur la carte pour trois autres noyaux : dans le roannais et les monts de la Madeleine au nord-ouest, puis à l’est, dans le massif des Chambaran, puis plus au sud l’agglomération grenobloise et les massifs montagneux qui l’entourent, Vercors, Chartreuse sud et Belledonne.
Des auteurs ont décrit les principaux types forestiers de Rhône-Alpes (Cochet & Fonters, op.cit.). En dehors de la zone méditerranéenne de la région, les types de forêts suivent l’étagement altitudinal classique. Ainsi, les feuillus, surtout implantés à basse altitude (chênaie-charmaies, chênaies pubescentes et autre types particuliers), laissent place aux forêts mixtes (hétraies-sapinières) de l’étage montagnard où se concentrent aussi les plantations de résineux comme dans le Pilat ainsi qu’aux pinèdes sylvestres climaciques des Alpes internes. Les pessières occupent ensuite l’étage alpin, surtout en versant nord. En zone méditerranéenne, c’est la chênaie verte qui domine (Ardèche et Drôme provençale).
Les secteurs concentrant le plus d’observations peuvent s’expliquer par la présence des types forestiers les plus recherchés par l’écureuil roux comme la forêt mixte ou les forêts et plantations de résineux, lui assurant une ressource alimentaire à toutes saisons. Partout ailleurs, l’espèce est présente, sans que de fortes concentrations d’observations ne soient particulièrement mises en évidence.
Dans le massif du Pilat, la forêt est constituée de plantations de résineux et de chênaies acidophiles continues et denses sur ses pentes nord. Plus au nord, de l’autre côté de la vallée du Giers, en se rapprochant de l’agglomération lyonnaise, les ensembles forestiers des monts du Lyonnais sont constitués de charmaies en limite sud de répartition, qui s’ajoutent aux chênaies acidophiles de chêne pubescent et de chêne pédonculé se développant dans des fonds de vallées aux sols riches. Dans le bassin de la Bresse, la chênaie pédonculée domine, en mélange quasi équitable avec la charmaie et la chênaie sessiliflore. Dans les monts du Forez et les monts de la Madeleine, des plantations denses de sapin de Douglas et d’épicéas complètent les sapinières. Dans les monts du Forez, la hétraie-sapinière est dominante. La pinède sylvestre est issue d’arbres plantés au milieu du XXème siècle. L’exploitation de cette forêt est donc rapide. Dans les Alpes internes, les pinèdes sylvestres climaciques dominent. Plus au sud, en Chambaran, les forêts de feuillus (châtaignier, mais également chênes et robinier faux accacia) composent le peuplement forestier. Dans les massifs pré-alpins autour de Grenoble la hétraie-sapinière puis la pessière dominent en versant nord. Enfin la moyenne vallée du Rhône, du sud de Valence jusqu’à Saint-Rambert-d’Albon, présente également un axe de présence significatif. Ici, la forêt est représentée par une succession de chênes, en basse altitude le chêne vert, et plus haut le chêne blanc souvent associé au pin sylvestre. Il est toutefois remarquable que le chêne vert soit mieux représenté en basse Ardèche qu’en Drôme provençale.
Hormis pour le département du Rhône, toutes les limites altitudinales dépassent largement les mille mètres. La donnée d’observation la plus élevée a été faite à Ornon (38) au lieu-dit la Pyramide, à 2633 mètres d’altitude. Il est remarquable de noter que les altitudes maximales d’observations réalisées dans les départements alpins dépassent largement les limites altitudinales des forêts. Cet ensemble correspond à ce qui est observé ailleurs dans les Alpes françaises, notamment en Provence-Alpes-Côte d’Azur (Rigaux 2016).
L’analyse de cette carte par maille se doit d’être complétée par l’analyse de celle des observations qui permet de conclure à une certaine homogénéité de la pression d’observation. Si l’absence d’observations dans les secteurs d’altitude ressort bien également, cette représentation met en évidence les vallées intra-alpines comme des voies de pénétration pour l’écureuil. C’est notamment le cas de la Maurienne, de la Tarentaise, de l’Arve et du Giffre. Deux autres secteurs biogéographiques apparaissent également comme des zones de moindre contact : la Bresse et les plateaux ardéchois du Coiron et des Gras. Pour ces derniers, le type de végétation forestière se rapporte au chêne pubescent ou au chêne vert. De plus, le pastoralisme entretient de vastes espaces ouverts et ne permet pas le développement de forêt haute (plutôt des maquis). Cela explique sans doute que les observations d’écureuils soient moins fréquentes. Le cas de la Bresse est différent, car bien que présentant un bocage relativement dense avec notamment des arbres de haut jet dans les haies, la moindre fréquence des observations est sans doute plutôt due à une moindre pression d’observation.
Menaces et conservation
 Ecureuil roux ©Pierre Crouzier
Ecureuil roux ©Pierre Crouzier
L’écureuil roux est aujourd’hui protégé, cependant la chasse et le braconnage ont conduit les populations à régresser au XXème siècle. Sous les noms de « vair » ou « petit-gris » sa fourrure était très appréciée.
Les menaces pesant sur les populations d’écureuils sont plurielles :
- dans la région, la fragmentation des massifs forestiers est une réalité et la pression de l’urbanisation et des infrastructures est prégnante ;
- la gestion de ces espaces forestiers est très intensive et les écosystèmes forestiers sont simplifiés (exemple des monts du Beaujolais) ce qui influence la ressource alimentaire et la diversité des milieux ;
- la circulation automobile ; il existe plus de 600 données de mortalité par écrasement routier sur la région, soit 2,5 % de l’ensemble des données (N = 25628). Cette cause de mortalité, sans doute largement sous-estimée, pourrait également être mise en relation avec le rapprochement entre l’écureuil roux et l’homme, à travers le nourrissage, l’amenant à fréquenter les zones péri-urbaines (Chapuis et al., 2012).
Ces trois principales menaces peuvent être complétées par d’autres plus ponctuelles.
La concurrence d’autres espèces de sciuridés introduites comme l’écureuil gris (Sciurus carolinensis) ou l’écureuil de Corée (Tamias sibiricus). La présence de la première espèce introduite d’Amérique du nord n’est pas avérée en Rhône-Alpes. La seconde est présente dans le Rhône (quelques individus isolés) et en Isère (commune d’Echirolles) avec 29 données sur ces deux départements (voir monographie sur l’écureuil de Corée).
Par ailleurs, l’écureuil roux est porteur de plusieurs parasites, poux ou tiques.
Pour les ectoparasites, on peut citer :
- 3 espèces de puces: Monospyllus scriurorum et plus rarement Orchopeas howardii en Grande-Bretagne, espèce venue d’Amérique du Nord avec l’écureuil gris (Sciurus carolinensis), et Taropsylla octodecimdentata en Europe continentale ;
- 2 espèces de poux (Enderleinellus nitzchi et Neohaematopinus sciri) ;
- plusieurs espèces de tiques, essentiellement du genre Ixodes, dont I. ricinus, vecteur notamment de la maladie de Lyme, trois espèces de bactéries (Borrelia burgdorferi, B. garinii , B. afzelii) ayant été identifiées chez l’écureuil roux (Pisanu et al., 2014).
Eu égard à cet ensemble d’éléments, les axes de conservation pourraient être les suivants :
- la limitation de la fragmentation des milieux, le développement des trames vertes à différentes échelles favorisant des continuums d’habitats favorables (forêts, bois, haies, espaces verts et jardins) ;
- un programme réel de quantification de la mortalité par collision sur les routes serait nécessaire ;
- la pose de dispositifs de franchissement de routes par la canopée (écuroducs) Bien que cette technique reste aujourd’hui controversée en terme d’efficacité, un suivi pilote serait donc utile ;
- la lutte contre les espèces exotiques d’écureuil dès leur apparition.
Les écuroducs
Les écuroducs sont des dispositifs visant à atténuer les effets de la fragmentation des habitats pour l’écureuil roux ou à effacer une infrastructure humaine rendant impossible ses déplacements.
Un dispositif aérien spécialement adapté a été imaginé pour permettre aux écureuils de franchir des grandes voies de circulation. Appelés « écuroducs », ils peuvent aussi être utilisés par d’autres mammifères, notamment des Gliridés (loirs, lérots). Encore expérimentaux dans différents pays du monde (Etats-Unis, Japon, Belgique, etc.), mais aussi en France (Isère, Savoie, Haute-Savoie), ces dispositifs sont constitués de câble ou autres cordages. Installés dans des endroits où la mortalité routière était très forte, il n’y a malheureusement pas (ou peu) de bilan chiffré de l’efficacité de ces dispositifs.
Rédacteurs: Olivier IBORRA, Jean-Louis CHAPUIS et Stéphane GARDIEN, octobre 2018









